متد و روش ها (2)
یکی از راههای ساده برای تشخیص مصرف، سوءمصرف یا وابستگی به انواع مواد مخدر، انجام تستهای ادراری است. این تستها بر پایهی تشخیص مواد، داروها یا متابولیتهای آنها در ادرار عمل میکند.
معمولاً تستها به روشهای مختلف انجام می شود، اما تستهای رایج موجود شامل موارد زیر است:
۱ تستهای نواری سریع (Test strip/ Rapid test) که سریع و در مطب قابل انجام است.
۲ تست کروماتوگرافی لایه نازک (Thin layer chromatography: TLC) که در برخی از آزمایشگاهها انجام میشود.
با توجه به رواج تستهای نواری و وجود نگرانی در زمینهی موارد مثبت و منفی کاذب، در این مقاله به بحث دربارهی تستهای نواری میپردازیم:
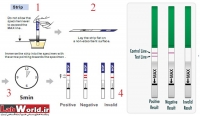
تستهای نواری
برای سنجش مورفین، حشیش، بنزودیازپینها، آمفتامین، متادون و… تستهای نواری مجزا وجود دارد. اساس تشخیصی این تستها وجود آنتیبادی مونوکلونال علیه مادهی قابل سنجش است. بهعنوان مثال در مورد مورفین، از آنتیبادی مونوکلونال مورفین که از سرم موش تهیه شده است استفاده میشود. چنانچه در نمونهی ادرار مورفین یا متابولیتهای آن وجود داشته باشد، با روش مهاجرت مویرگی به سمت بالا حرکت میکند و با آنتیبادی موجود پیوند (باند) میشود. در این صورت خط رنگی در نوار دیده نخواهد شد و نتیجهی تست مثبت گزارش میشود. البته خط دیگری بهعنوان شاهد وجود دارد که باید در تمام حالات دیده شود.
برای مثبت شدن تست باید میزان حداقل (Cut-off) آن در نمونه موجود باشد. این میزان در مورد مورفین ng /ml 300، در مورد کانابیس ng/ml 50 و در مورد متآمفتامین ng/dl 1000 است.
برای انجام تستها، ادرار در هر زمانی از شبانهروز جمع شود اشکالی ندارد. چنانچه ادرار در دمای ۲ تا ۸ درجهی سانتیگراد نگهداری شود، تست تا ۴۸ ساعت بعد هم قابل انجام است. برای زمان طولانیتر، نمونه باید فریز گردد و تست بعد از آب شدن نمونه انجام شود.
علل اختلال در آزمایش
شایعترین علل بروز اختلال در نتیجهی تستهای نواری شامل موارد زیر است:
خطا در نمونهگیری:
یکی از مهمترین دلایل بروز نتیجهی منفی (که هیچ ربطی هم به روش انجام تست ندارد!) بروز خطا در نمونهگیری است. معمولاً علیرغم حضور نمونهگیر و مشاهدهی مستقیم، بهجای نمونهی فرد مصرفکننده، نمونهی فرد سالم از سرنگ و… در ظرف تخلیه میشود! در چنین مواردی که معمولاً بیمار همکاری ندارد، کنترل درجهی حرارت نمونه بلافاصله بعد از جمعآوری کمک خواهد کرد. در مواردی نیز نمونهای غیر از ادرار ارایه میشود که متعاقباً توضیح داده خواهد شد.
خطاهای تکنیکی:
نوار تست باید بین ۱۰ تا ۱۵ ثانیه در ادرار نگه داشته شود. پس از آن قبل از خواندن جواب باید بهمدت ۵ دقیقه در یک سطح صاف غیرجاذب گذاشته شود. گزارش پاسخ سریع، بهویژه در یک دقیقهی اول و بعد از ۱۰ دقیقه، باعث پاسخ مثبت کاذب میشود.
رقیقکنندهها:
هر عاملی که باعث رقیق شدن ادرار شود، با پایین آوردن میزان Cut-off باعث پاسخ منفی کاذب میشود. در این موارد استفاده از نوارهای کمکی برای سنجش کراتینین، نیترات و گلوتامات ادرار میتواند رقت ادرار را نشان دهد. این نوارها در موارد ارایهی نمونهی غیرادراری نیز کمک میکند.
تغییرات PH:
اکثر تستها به تغییرات PH بین ۵ تا ۹ مقاوم هستند. کاهش یا افزایش PH فراتر از محدودهی فوق میتواند سبب اختلال در پاسخ شود. ریختن خون، مایع منی (Semen)، جوهر لیمو، سفیدکنندهها (Bleach) و… در ادرار گاهی با تغییر PH میتواند سبب اختلال شود. البته در این موارد علاوه بر ایجاد تغییرات ظاهری در رنگ و بو… استفاده از نوارهای سنجش PH کمک میکند.
زمان ردیابی مواد در ادرار
اکثر مواد تا ۷۲ ساعت پس از مصرف در ادرار قابل شناسایی است. در موارد اعتیاد مزمن و استفاده از مواد طولانیاثر مثل شیره، احتمال مثبت شدن تست در زمان طولانیتری پس از آخرین مصرف وجود دارد. زمان تقریبی ردیابی مواد مختلف در ادرار بهشرح زیر است:
حشیش: ۱ روز تا ۴ هفته
هروئین: ۳ تا ۴ روز
مورفین: ۲ تا ۳ روز
متادون: ۲ تا ۳ روز
آمفتامین: ۱ تا ۳ روز
کوکائین: ۲ تا ۴ روز
بنزودیازپین: ۳ روز تا ۳ هفته.
تداخلات دارویی
داروهای حاوی کدئین سبب بروز نتیجهی مثبت کاذب در تست مورفین میشود که در تست کروماتوگرافی (TLC) قابل تشخیص است و در محل شاهد کدئین لکه ایجاد میکند.
فنوباربیتال، دیفنوکسیلات و دکسترومتورفان تاثیری در نتیجهی تست نواری ندارند. همچنین مصرف ۴۰ میلیگرم فورزماید، علیرغم رقیق کردن ادرار، هیچ تاثیری در نتیجهی تست مورفین و بروز منفی کاذب ندارد.
مصرف قرصهای ضد حاملگی (کنتراسپتیوها) با دوز ۴ عدد HD تا ۳۶ ساعت سبب بروز منفی کاذب روی نتیجهی تستهای نواری و TLC میشود. کنتراسپتیو LD تغییری در نتیجهی تستها یا لکهای در TLC ایجاد نمیکند.
سایر دستههای دارویی رایج از جمله آمیتریپتیلین، دیازپام و آنتیبیوتیکها مثل آموکسیسیلین نیز معمولاً تداخلی در شناسایی مورفین ایجاد نمیکنند.
ادامه مطلب...در ایام گذشته آزمایش های تشخیص پزشکی توسط پزشکان انجام می شد ( ابوعلی سینا)
در سال 1916 دکتر Todd در دانشگاه کلرادو بخش آسیب شناسی بالینی را ایجاد کرد.
دستگاه رنگ سنج Klett Biocolorimeter در دهه 1930 ابداع شد.
در دهه 1940 فوتومتر و اسپکتروفتومتر ابداع شد (روش های دستی)
در دهه 1950 برای اولین بار توسط شرکت Technicon آمریکا دستگاه اتو آنالایزر به بازار عرضه شد.
روش های جذب سنجی
روش های جذب سنجی یکی از قدرتمندترین و رایج ترین روش های اندازه گیری طیف وسیعی از آنالیت ها محسوب می شوند. بسیاری از دستگاه های مورد استفاده در آزمایشگاههای تشخیصی بر پایه اندازه گیری میزان جذب یا عبور انرژی تشعشعی ساخته شده اند.
اسپکتروفتومتر یا فتومتر ابزاری است که برای اندازه گیری انرژی جذبی یا عبوری نور مورد استفاده قرار می گیرد.
تشعشع الکترومغناطیسی (EMR) جریانی از انرژی است که با سرعت نور در جهان انتشار می یابد. و به صورت امواج ماکسول و جریانی از ذرات تحت عنوان فوتون وجود دارد.
طیف فرکانس های EMR از مقادیر بسیار پایین در مورد امواج رادیویی تا مقادیر بالاتر از جمله امواج فرابنفش، اشعه ایکس و اشعه گاما متفاوت است.
جنس و خواص نور:
نور در واقع نوعی انرژی با خاصیت دو گانه موج و ذره است.
یک موج الکترومغناطیسی از دو جزء الکتریکی و مغناطیسی با مولفه های عمود بر هم در راستای جهت انتشار تشکیل شده است.
نوری که معمولا در درجه حرارت های بالاتر از مواد ساطع می شود علاوه بر خاصیت الکتریکی دارای خاصیت مغناطیسی نیز می باشد.
قوانین بیر- لامبرت (Beer - Lamberts):
هرگاه یک نور ساده تکفام با شدت I0عمود بر سطح تابش وارد یک محلول شفاف و یکنواخت به ضخامت L و غلظت C گردد بخشی از آن جذب شده قسمتی منعکس و قسمت دیگر از محلول عبور می کند بنابراین:
Ir+Ia+lt= I0
Ir: بخش انعکاس یافته است که میزان ناچیزی را به خود اختصاص می دهد.
Ia: بخش جذب شده که به غلظت آنالیت بستگی دارد.
It: بخش عبور کرده از محلول می باشد.
طبق نظر لامبرت هرگاه یک دسته شعاع نور تکفام (I) از محلولی به ضخامت L عبور کند کم شدن شدت نور متناسب با ضخامت محلول خواهد بود dI~L
طبق نظر بیر هرگاه یک دسته شعاع تکفام از محلولی به غلظت C عبور کند کم شدن شدت نور متناسب با غلظت آنالیت در محلول می باشد.
دستگاههایی که برای جذب سنجی به کار می روند عبارتند از: فتومترها و اسپکتروفتومترها. در فتومترها از فیلتر به عنوان تکفام ساز(Monochoromator) استفاده می شود لذا بخش محدودی از طول موج قابل دسترسی می باشد اما در اسپکتروفتومترها منشور و سیستمهای (Grating) به عنوان تکفام ساز عمل می کنند.
فتومترها و اسپکتروفتومترها:
اسپكتروفتومترها، تجهيزاتي است كه جذب يا عبور طول موجهاي مشخصي از انرژي تابشي (نور) از يك آناليت را در يك محلول تعيين ميكنند. به دليل تفاوت در تعداد و آرايش گروهها، پيوندهاي دوگانه اتمهاي كربن در هر مولكول نور را در طول موجهاي خاص با الگوي طيف مشخص، جذب ميكند. بر اساس قانون بير- لامبرت، مقدار نوري كه در اين طول موج مشخص جذب ميشود مستقيما با غلظت آن نمونه شيميايي متناسب است. اسپكتروفتومترهاي مرئي و فرابنفش، رايجترين دستگاههاي جذب سنجي در مراكز تشخيصي و آزمايشگاهي است.
اسپكتروفتومتر نور مرئي
در آزمايشگاهها، بخش گسترده اي از اندازه گيريها بر اساس واكنشهاي جذب سنجي صورت ميپذيرد. فعاليت اكثر آنزيمها، تري گليسيريد، كلسترول، ليپو پروتئينها، قند، كراتينين، اوره و... طيف وسيعي از آناليتها با كاربردهاي باليني و تحقيقاتي، طيف وسيعي از داروها و بخش گستردهاي از متابوليتها با اسپكتروفتومتري قابل سنجش است. بررسي ساختمان مولكولي، شناسائي تركيبات، مقايسه ساختمانها، يافتن طول موج ماكزيمم جذب و... از ديگر كاربردهاي اسپكتروفتومتري در مسائل تحقيقاتي است.
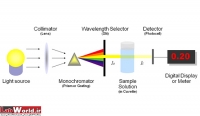
اجزا دستگاه:
شش قسمت اصلی در ساختمان اسپکتروفتومترها وجود دارد که عبارتند از:
1) منبع نور
2) مونوکروماتور
3) متمرکز کننده پرتو
4) محل نمونه
5) آشکارساز
6) دستگاه نمایش خروجی
1) منبع نور:
منبع نور در اثر افزایش حرارت به کمک الکتریسیته در یک لامپ تامین می شود شرایط اصلی این منبع شدت کافی، پایداری و پیوستگی اجزاء آن است. برای تامین نور مرئی از لامپ های تنگستن (با طول موج توليدي بين nm 900-330) استفاده می شود. برای تولید پرتوهای فرابنفش از لامپهای هیدروژنی یا دوتریومی (با طول موج nm 450 -200) بهره گرفته می شود.
2) تکفام ساز ((Monochromator:
این قسمت دستگاه پرتو چند فام را به پرتو تکفام تبدیل می کند این عمل ممکن است توسط منشور یا سیستم گریتینگ انجام شود. فیلترها شیشه های رنگی هستند که بخش اعظم پرتوها را جذب کرده و فقط طول موج های محدودی را عبور می دهند. فیلترها باید پرتویی را که آنالیت جذب می کند از خود عبور دهند. منشورها و سیستم گریتینگ بر اساس اختلاف ضریب شکست می توانند طول موجهایی حتی با پهنای 1/0 نانومتر تولید کنند. سیستم گریتینگ در اصل یک صفحه صیقلی است که تعداد زیادی خطوط نازک و موازی بر روی آن حک شده و کار منشور را به نحو بهتری انجام می دهد.
3) متمرکز کننده پرتو (Focusing device):
با ترکیبی از عدسی ها شکاف بین دو تیغه باریک فلزی و آیینه ها در مسیر پرتو تابش پرتوها مواز ی می شوند و با تنظیم عرض شکاف می توان عرض پرتو را تنظیم کرد. هر قدر عرض شکاف نور بکار رفته کمتر باشد کیفیت پرتوها بهتر خواهد بود.
4) محل نمونه:
کووتها (Cuvet) قسمتی از دستگاه هستند که نمونه مورد نظر یا بلانک در آن قرار می گیرد این بخش معمولا به صورت استوانه ای یا مستطیلی بوده از شیشه کوارتز یا پلاستیک ساخته شده است.
کووتهای پلاستیکی و شیشه ای برای محدوده مرئی بکار می روند. به دلیل جذب پرتوهای با طول موج کمتر از 350 نانومتر توسط کووتهای شیشه ای برای محدوده فرابنفش از کووتهای گران قیمت کوارتزی یا سیلیسی استفاده می شود.
5) آشکارسازها (Detectors):
آشکارسازها دستگاههایی هستند که یک نوع از انرژی را به نوع دیگری تبدیل می کنند و معمولا به سه گروه اصلی تقسیم می شوند: 1- فتوالکتریکی 2- فتوشیمیایی 3- حرارتی. در دستگاههای اسپکتروفتومتر از آشکارسازهای فتوالکتریکی استفاده می شود. فتوسل و فتوتیوب از ساده ترین آشکارسازها می باشند.
فتوترانزیستورها و فتودیودها نیز برای این منظور استفاده می شوند. برای اندازه گیری نورهای ضعیف از (Photomultiplier Tubes) PMT بهره گرفته می شود. PMTها سریعتر جواب می دهند وعلاوه بر حساسیت بالا با دوام تر از سایر آشکارسازها می باشند.
6) دستگاه نمایش خروجی
این قسمت می تواند یک گالوانومتر صفحه ثبات اسیلوسکوپ یا صفحه نمایشگر کامپیوتر با نرم افزارهای متنوع باشد.
اسپكتروفتومتر فرابنفش ((Ultraviolet
ساختماني همانند اسپكتروفتومتر نور مرئي داشته و به طول موجهاي نور فرابنفش حساس است.
اسپكتروفتومتر نشر شعله ((Flame
ساختمان اين دستگاه شبيه اسپكتروفتومتر يا فتومتر ساده است با اين تفاوت كه در فتومتر، لامپ الكتريكي و در اين دستگاه نور حاصل از سوختن ماده مورد آزمايش در درون شعله به عنوان منبع نوري در نظر گرفته ميشود. در طيف سنجي نشر شعله، نور حاصل مستقيما اندازهگيري ميشود.
اسپكتروفتومتر جذب اتمي (Atomic Absorption)
اسپكتروفتومترهاي جذب اتمي (AAS) غلظت عناصر فلزي كه از نظر پزشكي براي حفظ سلامتي مهم است را اندازه گيري ميكند. در خصوص اين عناصر ميتوان به كلسيم، منيزيم، مس، روي و آهن اشاره نمود. اسپكتروفتومترهاي جذب اتمي همچنين براي تعيين اينكه آيا سطح درماني داروهايي نظير ليتيم در خون، تامين شده است يا خير و همچنين براي آشكارسازي و تعيين كميت سموم فلزي مورد استفاده قرار ميگيرد.
تعیین طول موج ماکزیمم (maxλ)
محلول 10 میلی گرم در لیتر برومو فنول بلو را تهیه کنید. ابتدا صفر عبور را در حالی که دستگاه خالی است تنظیم کنید. در مرحله بعد به وسیله بلانک ( محلولی که تمام مواد موجود در محلول آزمایش را دارد به جز ماده مورد آزمایش) در دستگاه قرار دهید و دستگاه را روی عدد صد در صد عبور تنظیم نمائید. در این قسمت محلول مورد آزمایش را در طول موج های متفاوت بررسی نمائید و مقدار جذب نور را در آن طول موج ها به دست آورید. در نهایت منحنی مربوط به طول موج های خوانده شده را رسم کنید و حداکثر جذب خوانده شده مربوط به طول موج ها را مشخص نمائید. توجه داشته باشید که برای هر طول موج می بایست دستگاه را با بلانک صفر نمائید.
تایید قانون بیر- لامبرت
در این آزمایش منحنی دانسیته نوری را بر حسب غلظت های مختلف به دست خواهید آورد و قانون بیر- لامبرت را تائید خواهید نمود. با انتخاب 6 لوله آزمایش طبق جدول زیر عمل نمائید.
|
6 |
5 |
4 |
3 |
2 |
1 |
شماره لوله ها محلول ها |
|
5 |
4 |
3 |
2 |
1 |
- |
برمو فنول بلو(ml) |
|
- |
1 |
2 |
3 |
4 |
5 |
آب مقطر(ml) |
صفر دستگاه را با استفاده از لوله شماره 1 تنظیم نمائید و مقدار دانسیته نوری مربوط به لوله های بعدی را در طول موج ماکزیمم به دست آمده از مرحله قبل را بخوانید. سپس منحنی جذب نوری را در غلظتهای مختلف به دست آورده و مشخص نمائید که آیا قانون بیر- لامبرت تائید می شود یا نه؟
ادامه مطلب...